2022北京国际医疗器械展览会定于2022年9月20日-22日在中国国际展览中心(静安庄馆)举办!内容全面涵盖了医用电子、医学影像设备、光学、急救、康复护理、医疗用品及卫生材料、检验设备及诊断试剂以及医疗信息技术等医院全科室产品,直接并全面服务于医疗器械行业从源头到终端整条医疗产业链,每一届来自20多个国家的600余家医疗器械生产企业和超过30000人次的医院买家和经销商、代理商汇聚CMEH交易、交流。
来源:CMDE

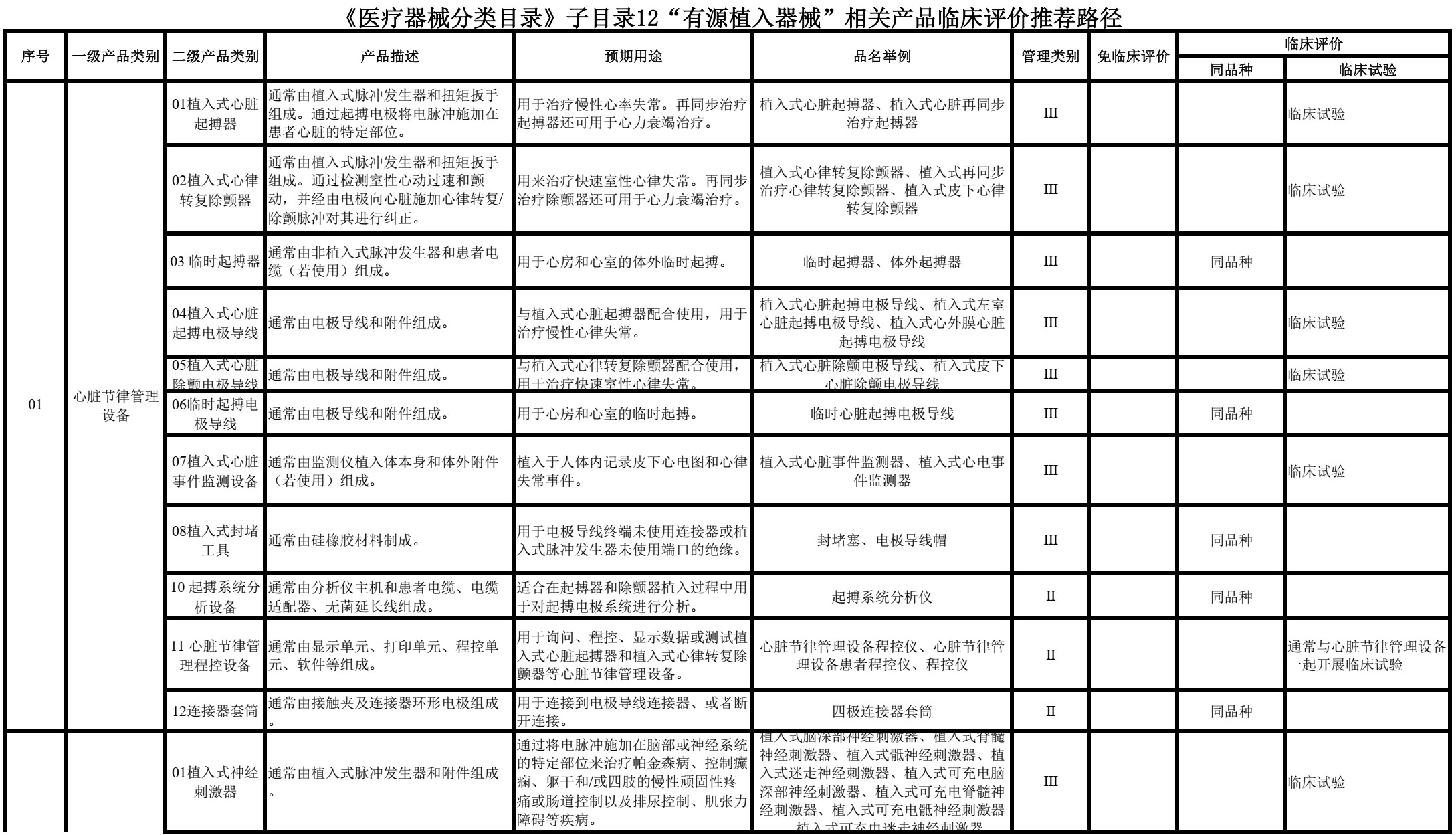
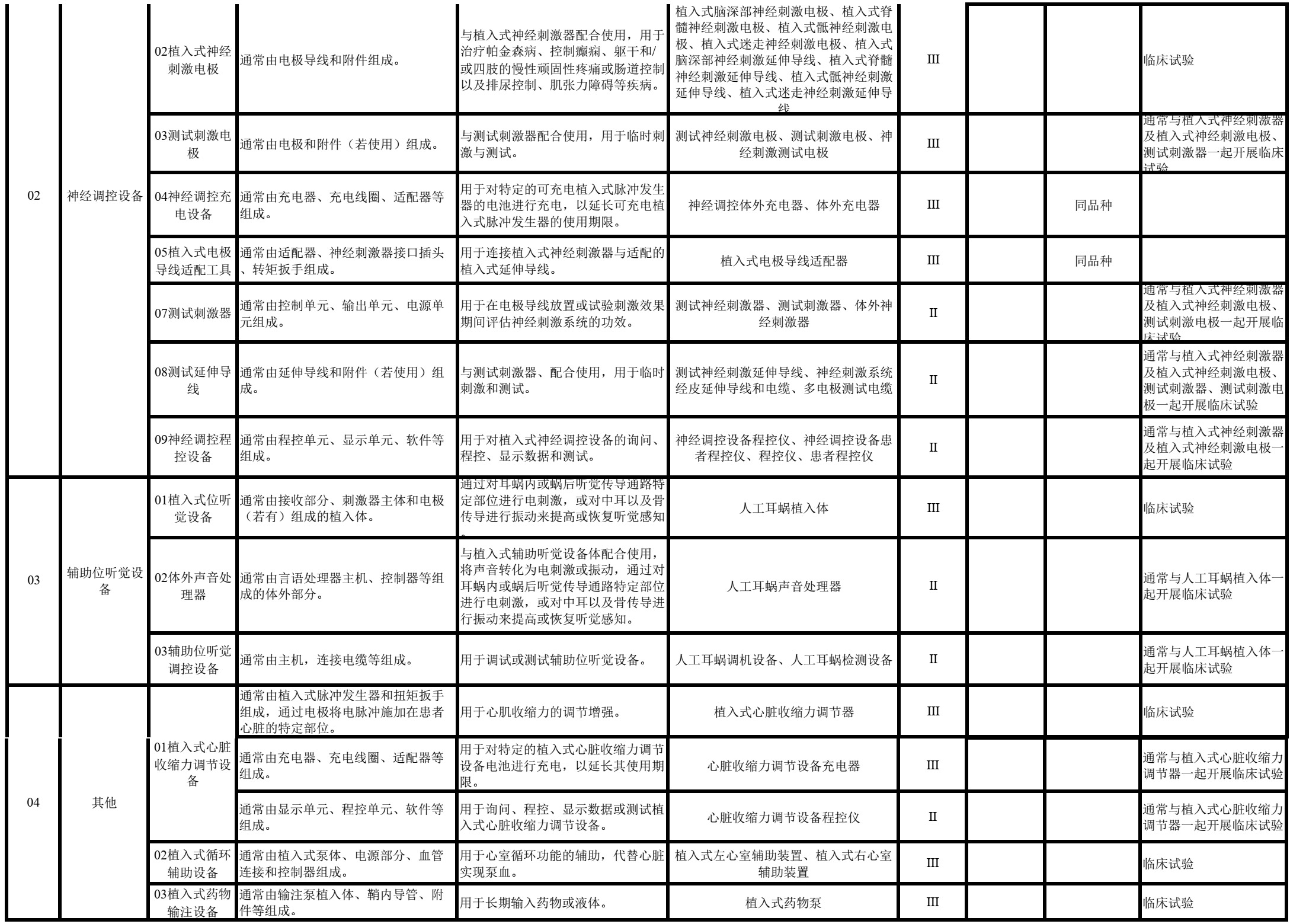
2021年6月,新版《医疗器械监督管理条例》(国务院第739号令)施行,明确规定“进行医疗器械临床评价,可以根据产品设计特征、临床风险、已有临床数据等情形,通过开展临床试验,或者通过对同品种医疗器械临床文献资料、临床数据进行分析评价,证明医疗器械安全、有效”。
2021年9月,国家药监局发布医疗器械临床评价配套规范性文件,其中《决策是否开展医疗器械临床试验技术指导原则》(2021年第73号,以下简称“《决策导则》”)从“高风险医疗器械”、“新型医疗器械”、“已有证据的充分性”三个方面指导申请人决策申报产品是否需要开展临床试验。
编写了《医疗器械分类目录子目录11“医疗器械消毒灭菌器械”相关产品临床评价推荐路径》《医疗器械分类目录子目录12“有源医疗器械”相关产品临床评价推荐路径》《医疗器械分类目录子目录13“无源医疗器械”相关产品临床评价推荐路径》《医疗器械分类目录子目录“14 注输、护理和防护器械”相关产品临床评价推荐路径》《医疗器械分类目录子目录“15 患者承载器械”相关产品临床评价推荐路径》《医疗器械分类目录子目录“17 口腔科器械”相关产品临床评价推荐路径》《医疗器械分类目录子目录“22 临床检验器械”相关产品临床评价推荐路径》,给出具体产品临床评价路径选择的推荐意见。对于产品数量较少,近几年无相关产品申报的,暂未在该文件中体现。
文件中标注“临床试验”的产品,基于目前认知,通常为《决策导则》中的“高风险医疗器械”,除该指导原则第三部分第(一)款中可考虑免于开展临床试验的情形,原则上需要开展临床试验。
文件中标注“同品种”的产品,如申报产品与同品种医疗器械相比,适用范围、技术特征和/或生物学特性等方面具有显著差异,属于《决策导则》中提出的“新型医疗器械”,除《决策导则》第三部分第(二)款中可考虑免于开展临床试验的情形,需提交申报产品的临床试验资料。
文件中标注“同品种”的产品,如不属于《决策导则》中提出的“新型医疗器械”,申请人可按照《医疗器械临床评价技术指导原则》《医疗器械临床评价等同性论证技术指导原则》《医疗器械注册申报临床评价报告技术指导原则》(2021年第73号)的相关要求,根据申报产品特征、临床风险、已有临床数据等情形,选取合适的同品种医疗器械,通过对同品种医疗器械临床数据进行分析评价,证明医疗器械的安全性、有效性。此种情形下,如通过非临床研究未能证明差异性部分的安全有效性,即《决策导则》中提出的“已有证据不能证明产品符合医疗器械安全和性能基本原则”。
例如,常规功能的胰岛素泵可采用同品种比对途径提交临床评价资料,但具有闭环调节功能或采用新型闭环调节软件算法的胰岛素泵属于“新型医疗器械”,需提交申报产品的临床试验。
来源:CMDE
免责声明
本文来源为其他媒体的内容转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。